I. Свойства гидроксильной группы
Кислотные свойства – выражены ярче, чем у предельных спиртов (окраску индикаторов не меняют):
С активными металлами-
2C6H5-OH + 2Na → 2C6H5-ONa + H2
фенолят натрия
Со щелочами -
C6H5-OH + NaOH (водн. р-р) ↔ C6H5-ONa + H2O
! Феноляты – соли слабой карболовой кислоты, разлагаются угольной кислотой –
C6H5-ONa + H2O + СO2 → C6H5-OH + NaHCO3
По кислотным свойствам фенол превосходит этанол в 106 раз. При этом во столько же раз уступает уксусной кислоте. В отличие от карбоновых кислот, фенол не может вытеснить угольную кислоту из её солей
C6H5-OH + NaHCO3 = реакция не идёт – прекрасно растворяясь в водных растворах щелочей, он фактически не растворяется в водном растворе гидрокарбоната натрия.
Кислотные свойства фенола усиливаются под влиянием связанных с бензольным кольцом электроноакцепторных групп (NO2-, Br-)
C6H5-OH< п-нитрофенол < 2,4,6-тринитрофенол
2,4,6-тринитрофенол или пикриновая кислота сильнее угольной
Свойства бензольного кольца
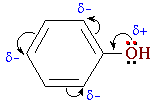
Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы (см. выше), но и в большей реакционной способности бензольного ядра. Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто- и пара-положениях (+М-эффект ОН-группы):
Поэтому фенол значительно активнее бензола вступает в реакции электрофильного замещения в ароматическом кольце.
Нитрование. Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов:
Нитрование тимола в среде уксусного ангидрида и концентрированной серной кислоты с образованием производного индофенола
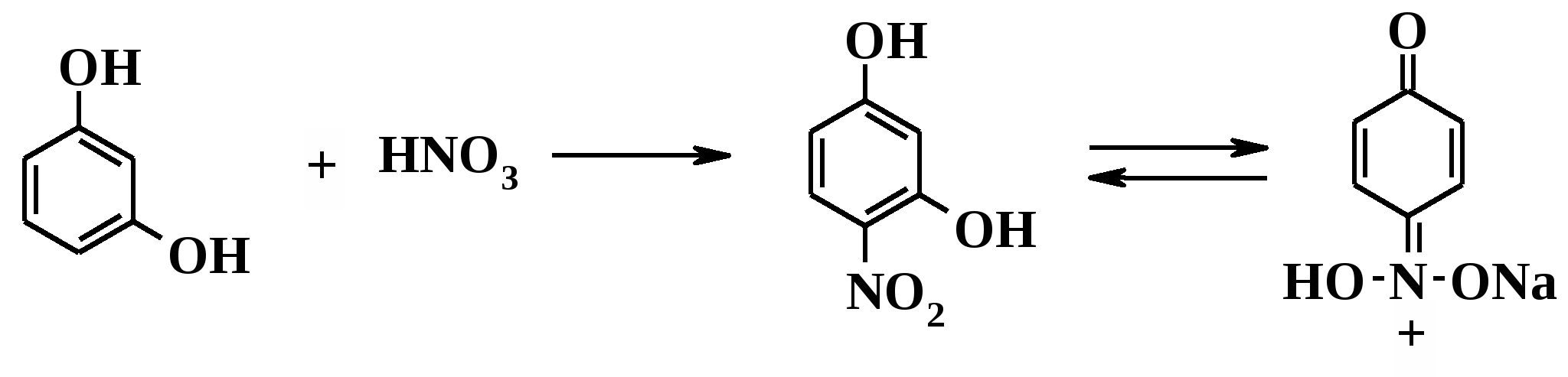
Нитрование резорцина
Галогенирование. Фенол, тимол, резорцин легко при комнатной температуре взаимодействуют с бромной водой с образованием белых осадков:
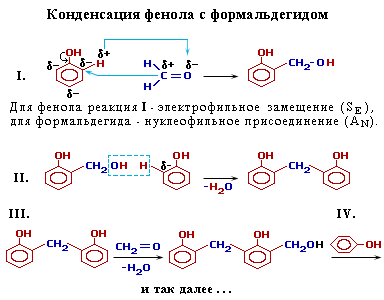
Конденсация с альдегидами. Например:
Фенолформальдегидные смолы
Гидрирование фенола
C6H5-OH + 3H2 Ni, 170ºC → C6H11 – OH циклогексиловый спирт (циклогексанол)